Aktuelle News
Neuer Behandlungsansatz
Gendefekt als Ursache von kindlichem Asthma identifiziert
Wissenschaftler:innen haben einen Meilenstein in der Erforschung von kindlichem Asthma erzielt. Ihre Studie zeigt, wie ... weiter
Tigermücken
Zika-Virus noch nicht gefährlich für Deutschland
Das Zika-Virus ist für Kinder und Menschen selten eine ernsthafte Erkrankung, aber sehr gefährlich für einen Fetus, ... weiter
KI im Fokus
105. Deutscher Röntgenkongress in Wiesbaden
Vom 8. bis zum 10. Mai 2024 trifft sich die radiologische Community auf dem 105. Deutschen Röntgenkongress in Hessens ... weiter
Reaktion des Immunsystems
Wirkung der Corona-Impfungen bei Gesunden und Dialyse-Patienten verglichen
Ob jemand bereits eine Corona-Erkrankung hatte oder nicht, kann durchaus einen Unterschied in der Wirkung einer Impfung ... weiter
Krankheitsmechanismen
Bedeutung von Biomolekülkonzentrationen im Blut bei Vorhofflimmern untersucht
Eine Analyse der Biomolekül-Teilstudie der EAST – AFNET 4 Studie ergab: Biomolekülkonzentrationen im Blut von ... weiter
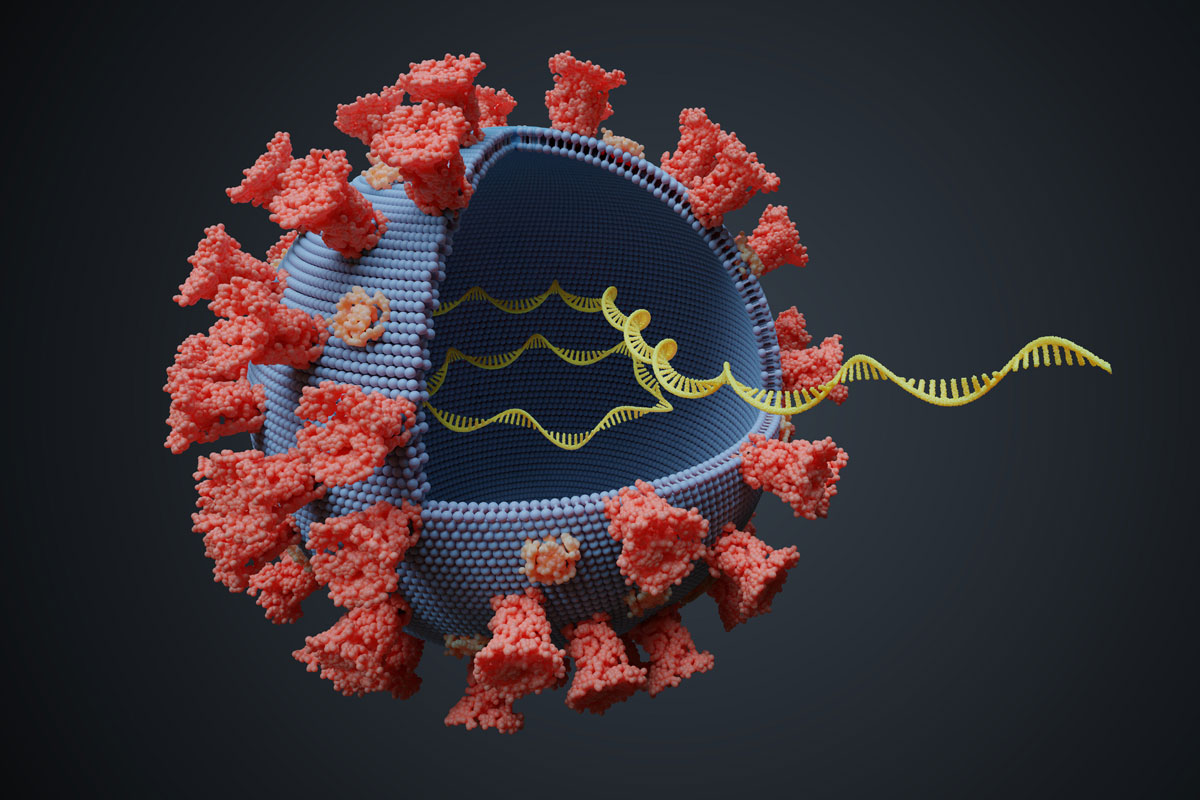
CRISPR-Tool
Bekämpfung der RNA-Viren durch neuartiges System
Das Aufkommen von RNA-Viren wie SARS-CoV-2 macht deutlich, dass neue Wege zu ihrer Bekämpfung gefunden werden müssen. ... weiter
Wechselwirkung
Verbindung zwischen Schilddrüse und Broken-Heart-Syndrom entdeckt
Die Symptome erinnern an einen Herzinfarkt: Menschen mit einer Stress- oder Takotsubo-Kardiomyopathie verspüren ... weiter
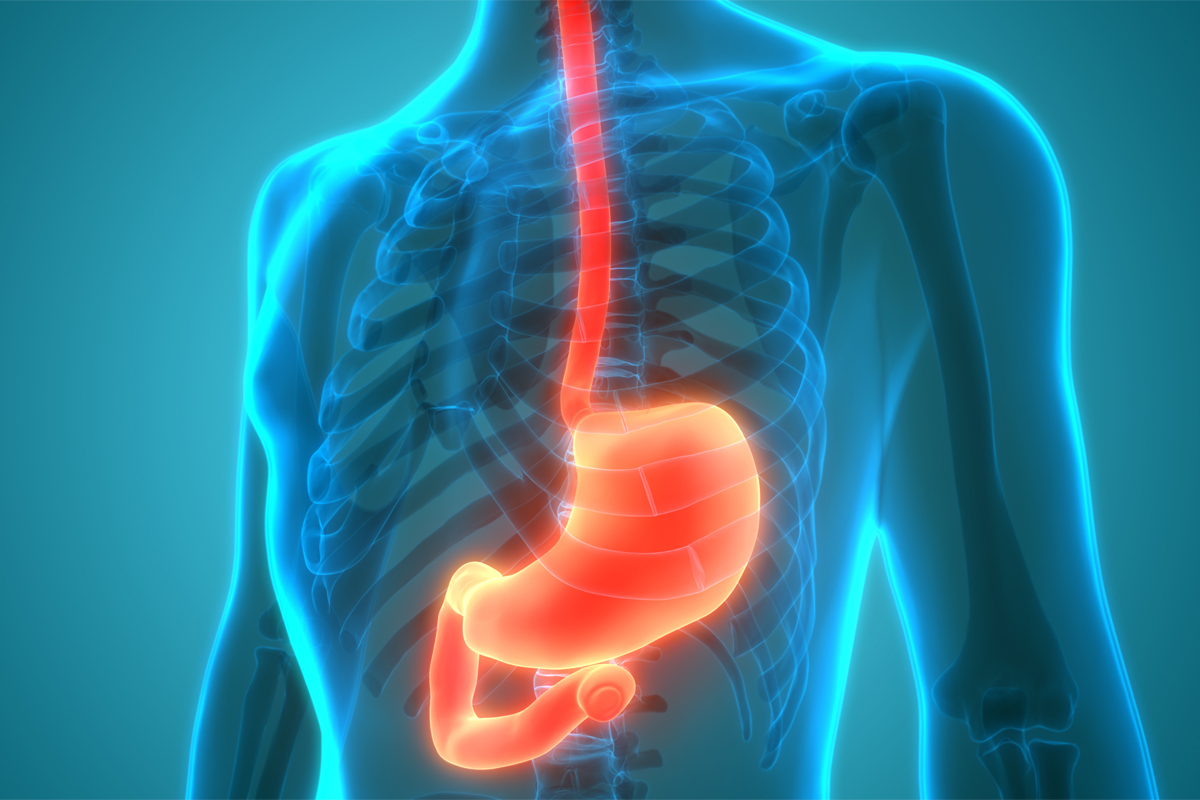
Gastroösophageale Verbindung
Untersuchung der zellulären Interaktion im Magen-Darm-Trakt
Der Übergang von der Speiseröhre zum Magen ist aus medizinischer Sicht eine heikle Region. Jetzt hat ein ... weiter
Molekulare Wirkung
Entzündungshemmung durch Kortison untersucht
Kortison-Präparate drosseln äußerst wirksam überschießende Immunreaktionen. Erstaunlich wenig war bisher ... weiter
Im Fokus
Tigermücken
Zika-Virus noch nicht gefährlich für Deutschland
Das Zika-Virus ist für Kinder und Menschen selten eine ernsthafte Erkrankung, aber sehr gefährlich für einen Fetus, ... weiter
Newsletter abonnieren
News und Jobs direkt ins Postfach
Registriere dich jetzt für unseren kostenlosen Newsletter. Alle 14 Tage erhältst du per E-Mail unsere Top-Artikel sowie eine Auswahl aktueller Stellenangebote.
Meistgelesener Artikel
Gastroösophageale Verbindung
Untersuchung der zellulären Interaktion im Magen-Darm-Trakt
Der Übergang von der Speiseröhre zum Magen ist aus medizinischer Sicht eine heikle Region. Jetzt hat ein ... weiter
Termine
Digitale Infoveranstaltung zur MTL-Ausbildung
Unverbindliche digitale Infoveranstaltung über die MTL-Ausbildung am Gesundheitscampus ... weiter
Veranstalter: Schule für Medizinische Technologie für Laboratoriumsanalytik am Gesundheitscampus Potsdam
Digitale Infoveranstaltung zur MTL-Ausbildung
Unverbindliche digitale Infoveranstaltung über die MTL-Ausbildung am Gesundheitscampus ... weiter
Veranstalter: Schule für Medizinische Technologie für Laboratoriumsanalytik am Gesundheitscampus Potsdam
TAE-Seminar: CT und MRT für die oberen Extremitäten – Update
Kombikurs an Siemens Definition Flash und Siemens Magnetom Skyra / ... weiter
Veranstalter: Technische Akademie Esslingen e.V.